Pronti per il nuovo MDR con Amoena
Il Regolamento sui dispositivi medici, MDR in breve, è il nuovo regolamento UE sui dispositivi medici entrato in vigore a maggio 2017 e con applicazione prevista dal 26 maggio 2020.
A causa della pandemia di Covid-19 , l'applicazione dell'MDR è stata rinviata di un anno, al 26 maggio 2021.
Il nuovo regolamento intende migliorare la qualità, la sicurezza e l'affidabilità dei dispositivi medici. Un requisito fondamentale del MDR è che i doveri, i compiti e le responsabilità tra il produttore e il distributore dei prodotti siano chiaramente definiti. Ciò include, ad esempio, la definizione dei ruoli tra produttore e distributore e il loro rapporto reciproco, garantendo la tracciabilità del prodotto e mantenendo la documentazione adeguata.
Amoena è ben preparata per l'applicazione del nuovo regolamento sui dispositivi medici. Nell'implementare i requisiti MDR abbiamo reso le modifiche il più pratiche, semplici e trasparenti possibile per entrambe le parti: per noi come produttori e per i nostri partner in quanto distributori.
Per semplificarti la vita, abbiamo riassunto le modifiche che sono state apportate (ad esempio sulla nostra confezione) e gli obblighi per i distributori (che possono essere trovati nell'articolo 14 del MDR).
Quali sono le conseguenze concrete del MDR?
Secondo l'MDR, sono necessarie informazioni estese per l'etichettatura dei dispositivi medici. D'ora in poi, oltre al codice che identifica chiaramente i prodotti, troverete ulteriori dati e simboli sulla confezione e sull'etichetta. I prodotti sotto la responsabilità di Amoena Medizin-Orthopädie-Technik GmbH (distributore e produttore) possono essere riconosciuti dal nostro indirizzo dietro un simbolo di fabbrica nero sull'etichetta o sulla confezione:
 Amoena Medizin-Orthopädie-Technik GmbH
Amoena Medizin-Orthopädie-Technik GmbH
Kapellenweg 36, 83064 Raubling, Germany
www.amoena.com
Come comportarsi coi prodotti meno recenti (vedi Art. 120 par. 4 MDR)?
I prodotti con vecchie etichette possono:
- essere venduti dal rivenditore specializzato fino a maggio 2025,
purché la data di scadenza non venga superata prima di tale data. - Questo vale anche per i prodotti che sono stati consegnati prima del 26 maggio 2021. Questi sono considerati immessi sul mercato e non devono essere rietichettati.
Quali sono i requisiti per l'etichettatura?
Oltre al ben noto marchio CE , troverete nuovi simboli di cui vi illustriamo il significato qui di seguito:
 | Data di scadenza: Dalla data di validità del MDR, i prodotti devono riportare una data di fabbricazione o di scadenza. Le nostre protesi mammarie esterne e i prodotti per la loro cura riportano ora una data di scadenza. La data di scadenza è determinata sulla base di studi sulla durata di conservazione.
I prodotti scaduti non possono più essere venduti.
|
 | Data di fabbricazione (= data di spedizione): Dalla data di validità del MDR, i prodotti devono riportare una data di fabbricazione o di scadenza. I nostri prodotti post-intervento e gli altri prodotti tessili riportano ora la data di produzione.
|
 | Numero di riferimento: Questo simbolo è riportato prima del numero dell'articolo
|
 | Numero di serie: Questo simbolo è riportato prima del numero di serie
|
 | Numero di lotto di produzione: Questo simbolo è riportato prima del numero di lotto di produzione
|
 | Il simbolo "MD" sta per Medical Device – Questo simbolo è riportato per indicare che il prodotto è un dispositivo medico |
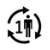 | Paziente unico - uso multiplo: il prodotto può essere utilizzato più volte dallo stesso paziente |
 | Ulteriori informazioni contenute nelle Istruzioni d'uso |
 | Se la confezione è danneggiata, il prodotto non deve essere utilizzato |
 | I prodotti sotto la responsabilità di Amoena GmbH (produttore) possono essere riconosciuti dal nostro indirizzo dietro un simbolo di fabbrica nero sull'etichetta o sulla confezione |
 | Proteggere dalla luce del sole |
Riguardo alle istruzioni d'uso?
Nel caso molto improbabile di un "incidente grave" con un dispositivo medico della nostra classe di rischio, il legislatore ci obbliga a fare riferimento a un obbligo di segnalazione nelle istruzioni per l'uso. Inoltre, come richiesto dall'MDR, troverete anche le nostre attuali istruzioni per l'uso sulla nostra homepage al più tardi entro la scadenza.
Per ulteriori eventuali domande sull'MDR, non esitate a contattarci.




 Amoena Medizin-Orthopädie-Technik GmbH
Amoena Medizin-Orthopädie-Technik GmbH








